Extraction de composés d'intérêt des microalgues
Les microalgues sont des usines cellulaires qui produisent des composés d’intérêt industriel (pigments, lipides neutres pour la production de biocarburants…). L’extraction de telles molécules nécessite généralement l’utilisation de solvants, souvent toxiques, couplée à une étape de prétraitement de la biomasse pour améliorer l’efficacité de celle-ci, et qui est en général très énergivore, en alourdissant ainsi l’impact environnemental et les coûts du procédé global.
Dans le cadre de l’extraction de lipides à des fins de production de biocarburants, nous nous sommes intéressés aux prétraitements électriques PEF (champs électriques pulsés) et mécaniques, et en particulier aux phénomènes mis en jeu à l’échelle microscopique, en collaboration avec le laboratoire SATIE de l’ENS Paris Saclay et l’ESIEE Paris. Nous avons conçu et réalisé des outils originaux, notamment des microsystèmes dédiés (Lab-on-chip) couplés à l’imagerie (figure ci-dessous), qui ont permis d’évaluer in situ et en temps réel la réponse de la cellule aux différentes sollicitations appliquées.
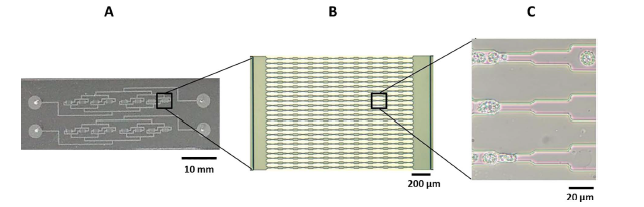
Système microfluidique (A) utilisé pour induire la sollicitation mécanique, contenant un réseau de capillaires (B), Déformation d’une cellule de Chlamydomonas reinhardtii passant l’une des restrictions dont les dimensions (5 µm) sont inférieures à la taille de la cellule (10 µm) (C)(1).
Nous avons ainsi mis en évidence des effets majeurs des prétraitements sur la cellule, très peu décrits dans la littérature : une augmentation de la perméabilité membranaire et des changements intracellulaires originaux suite à l’application des PEF(2) (images ci-dessous) et des solvants organiques(3)et une déformation de la cellule, stable dans le temps, suggérant un effet sur la paroi cellulaire, après la sollicitation mécanique. De plus nous avons déterminé les conditions opératoires de PEF permettant de perméabiliser les cellules, de façon réversible et irréversible, tout en minimisant la consommation d’énergie. Des valeurs clairement inférieures à celles requises par les procédés classiques de broyage (2 et 5 MJ/kg pour les conditions réversibles et irréversibles(4)) ont été déterminées.
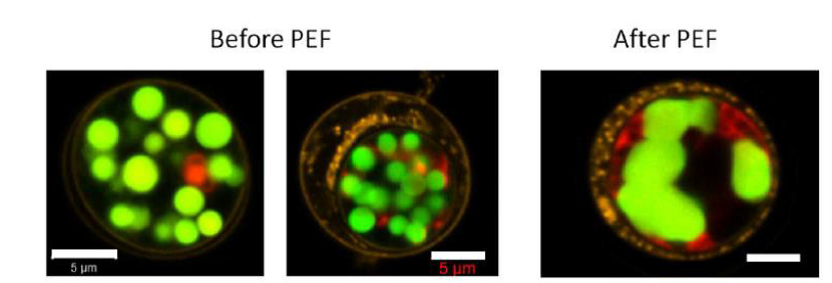
Microscopie confocale laser à balayage des cellules de Chlamydomonas reinhardtii avant et après traitement par PEF (7 kV/cm, 5 μs, 10 impulsions, 10 Hz). Paroi cellulaire marquée à la Concanavalin A (jaune), lipides neutres marqués au Bodipy (vert), autofluorescence de la chlorophylle (rouge). Après PEF, coalescence des gouttelettes de lipides à l’intérieur de la cellule et changement de la morphologie de celles-ci.
Par ailleurs, une nette intensification de l’extraction de lipides a été obtenue en couplant les deux prétraitements (PEF puis sollicitation mécanique) à l’extraction par solvant organique (augmentation de 25% des lipides extraits par rapport au solvant seul). Nous avons également proposé un mécanisme original, à l’échelle microscopique, pour cette suite d’étapes : les barrières cellulaires (paroi et membrane) sont significativement fragilisées par le couplage de technologies rendant plus facile l’action du solvant par la suite. Cette étude, dont les résultats sont très prometteurs, a permis ainsi de mieux appréhender les phénomènes en place et d’envisager un schéma global de procédé. Enfin, notre plateforme « lab-on-chip » couplée à l’imagerie est un outil intéressant qui peut être utilisé pour le criblage comportemental de différentes microalgues sous sollicitations dans le contexte de développement de procédés innovants d’extraction de molécules d’intérêt.
Références : (1) Bensalem, S., Lopes, F., Bodénès, P., Pareau, D., Français, O., & Le Pioufle, B. (2018). Understanding the mechanisms of lipid extraction from microalga Chlamydomonas reinhardtii after electrical field solicitations and mechanical stress within a microfluidic device. Bioresource Technology 257 : 129-136.
(2) Bodénès, P., Lopes, F., Pareau, D., Français, O., & Le Pioufle, B. (2016). Microdevice for studying the in situ permeabilization and characterization of Chlamydomonas reinhardtii in lipid accumulation phase. Algal Research, 16, 357-367.
(3) Bensalem, S., Lopes, F., Bodénès, P., Pareau, D., Français, O., & Le Pioufle, B. (2018). Structural changes of Chlamydomonas reinhardtii cells during lipid enrichment and after solvent exposure. Data in Brief, 17, 1283-1287.
(4) Bodénès, P., Bensalem, S., Français, O., Pareau, D., Le Pioufle, B., Lopes, F. Inducing reversible or irreversible pores in Chlamydomonas reinhardtii with electroporation: impact of the treatment parameters (En revision Algal Research).